

Plano de estudos de Química: estude para Enem e vestibulares
Os tópicos de química estão presentes na maioria dos vestibulares do país e é fundamental que você esteja preparado para se dar bem na hora da prova. Não sabe por onde começar? Vamos te ajudar com isso!
Neste material, você vai encontrar uma breve introdução sobre os assuntos de química que possuem maior possibilidade de aparecerem nos exames. Dessa forma, poderá organizar a sua rotina de estudos e se aprofundar em cada tema. Depois de estudar cada um dos tópicos do nosso plano de estudos de química, não se esqueça de fazer o nosso simulado para fixar o que aprendeu e entender onde precisa focar mais.
Vamos juntos?! ?
Neste artigo você vai encontrar:
Reações químicas
Quando uma ou mais substâncias sofrem alterações em suas composições ocorre a chamada reação química. Isso acontece quando as ligações entre átomos são rompidas e depois reagrupadas, ligando-se de maneiras diferentes e formando novas substâncias. Nesse fenômeno, as reações iniciais são os reagentes e as finais os produtos.
Nos vestibulares, as questões costumam apresentar aos candidatos as estruturas moleculares – especialmente as moléculas orgânicas – para que sejam analisadas as formas como interagem com o meio.
Para se sair bem, é importante conhecer as nomenclaturas para conseguir interpretar os fenômenos e situações propostas na questão. Para começar a se familiarizar com o tema, conheça as cinco reações químicas mais cobradas nos vestibulares:
Reação de combustão
Existem dois tipos de combustão: completa e incompleta. Por ser bastante presente em nosso cotidiano, por conta da geração de energia resultante, essa reação tem grandes chances de aparecer no vestibular.
Nesse caso, é importante se lembrar de que as reações de combustão sempre ocorrem na presença do oxigênio (O2) e liberam, como produto, gás carbônico e água (CO2 + H2O) na combustão completa e monóxido de carbono e água (CO + H2O) ou carbono e água (C + H2O) na combustão incompleta.
O gás metano (CH₄) é um hidrocarboneto de efeito estufa, produzido em aterros sanitários (Figura 1) pela decomposição de material orgânico por meio de bactérias, podendo ser usado para produção de energia. Abaixo estão descritas as reações químicas completa e incompleta usando o gás metano como combustível.
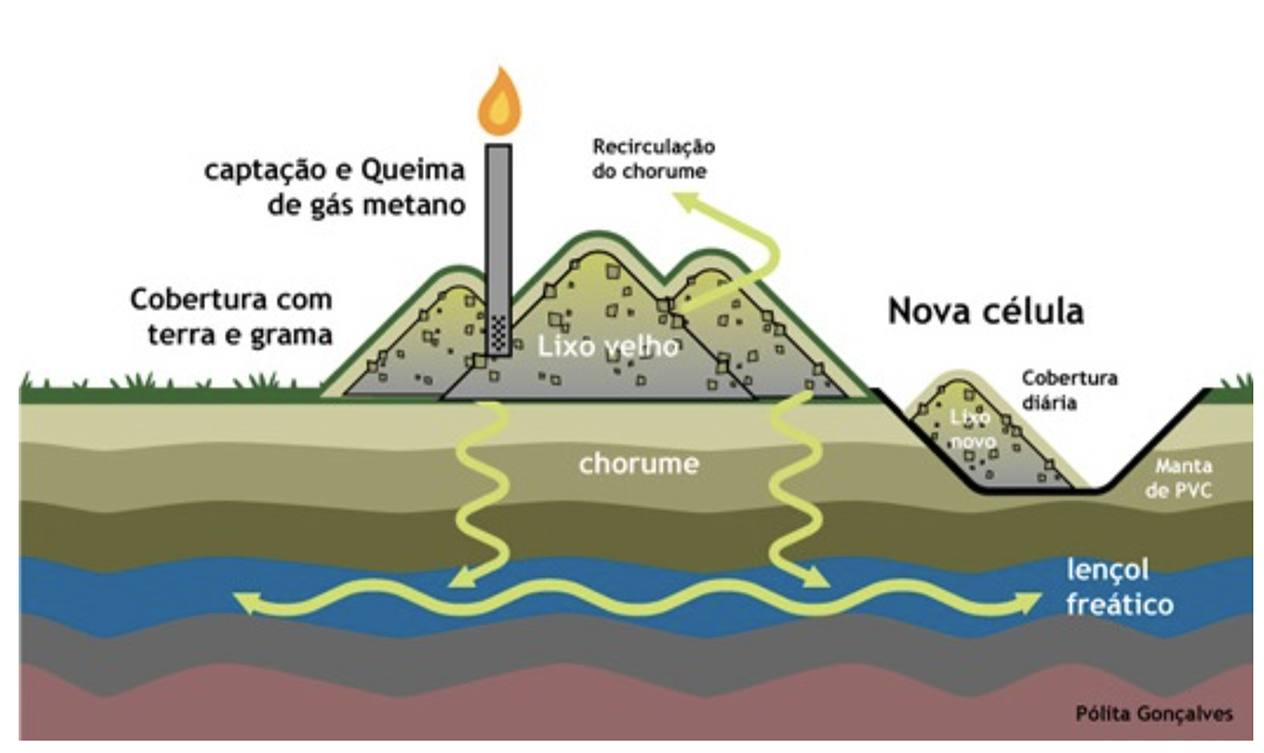
Figura 1: Aterro Sanitário Controlado – Fonte: Prefeitura de Ituiutaba Lixo Zero (2015).
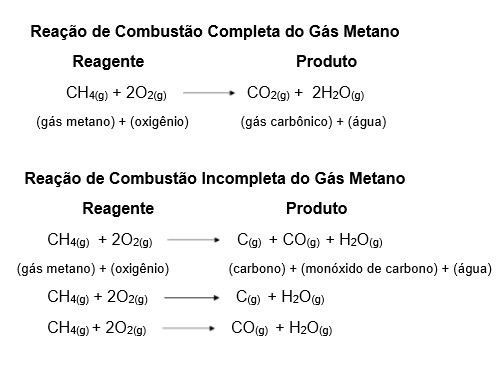
A reação química é considerada incompleta quando não há oxigênio (O2) suficiente para formar o gás carbônico (CO2). No seu lugar se forma o carbono, monóxido de carbono e água (C + CO + H2O) ou apenas um dos dois; carbono e água (C + H2O) ou monóxido de carbono e água (CO + H2O).
A fuligem criada pelo carbono ou monóxido de carbono é um poluente liberado pela queima de combustíveis em veículos, indústrias, dentre outros, sendo responsável pelos gases de efeito estufa (Figura 2).

Figura 2: Fuligem liberada por indústrias
Reação de neutralização
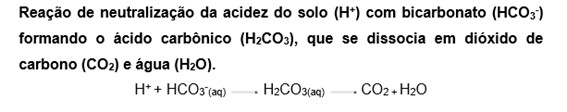
A reação de neutralização ocorre entre ácidos e bases e formam sal e água como produto. Esse fenômeno é bastante utilizado no processo de tratamento de água, na agricultura – corrigindo a acidez do solo – e tratamento de resíduos no meio ambiente.
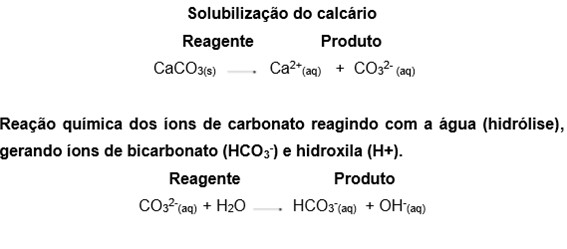
A neutralização do solo se faz necessária quando o mesmo se apresenta acidificado (com pH ácido – escala na Figura 3). A acidificação do solo é um fenômeno natural progressivo que ocorre devido a diminuição de cálcio (Ca), magnésio (Mg) e potássio (K), que são alguns dos principais nutrientes absorvidos pelas plantas no solo. Mas a acidificação também pode ocorrer pela ação humana, devido ao cultivo intensivo e uso de pesticidas. Desta maneira, uma das formas de diminuir a acidez do solo é pelo processo de calagem (Figura 4), onde é usado o carbonato de cálcio (CaCO3), principal componente da rocha calcaria, que adicionado ao solo úmido reage com a água (H2O), neutralizando a acidez (gerada por íons de hidrogênio) e melhorando a nutrição das plantas. Abaixo estão descritas suas reações químicas.
Figura 3 – Escala de pH do solo.

A equação a seguir mostra a decomposição do carbonato de cálcio (CaCO3) e a liberação dos íons cálcio (Ca2+) e carbonato (CO32−) por meio da solubilização.
Reação de oxirredução
A reação de oxirredução ocorre pela transferência de elétrons entre as substâncias químicas. Essa reação está presente em processos de corrosão de metais (ferrugem), eletrólise, entre outros. As transformações químicas ocorrem constantemente ao nosso redor, e uma das mudanças mais visíveis é a formação de ferrugem que se dá pela oxidação do ferro pela influência do ar e da umidade. Se deixarmos uma ferramenta exposta no quintal por diversos meses, o que ocorre a ela? Formação de ferrugem (Figura 5).
A ferrugem, conhecida como corrosão, ocorre na presença de oxigênio (O2) e ferro (Fe) pela reação de oxirredução. Ela deteriora pouco a pouco o material original. Abaixo é descrita sua reação química.

Figura 5 – Ferramentas enferrujadas que sofreram oxidação expostas ao ar.
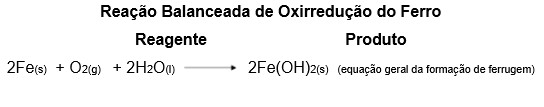
Reação de hidratação dos óxidos
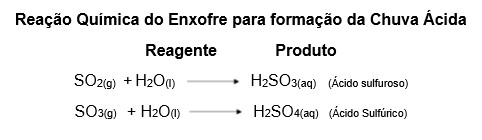
Essa reação é resultado da reação entre óxidos ácidos, especialmente, nitrogênio (N) e enxofre (S) com a água da chuva, o que dá origem à chuva ácida. A chamada “chuva ácida” se refere à acidez acentuada produzida na água da chuva pela poluição atmosférica causada por dióxido de enxofre (SO2) e dióxido de nitrogênio (NO2) provenientes da queima de combustíveis (Figura 6). Abaixo é descrita sua reação química.
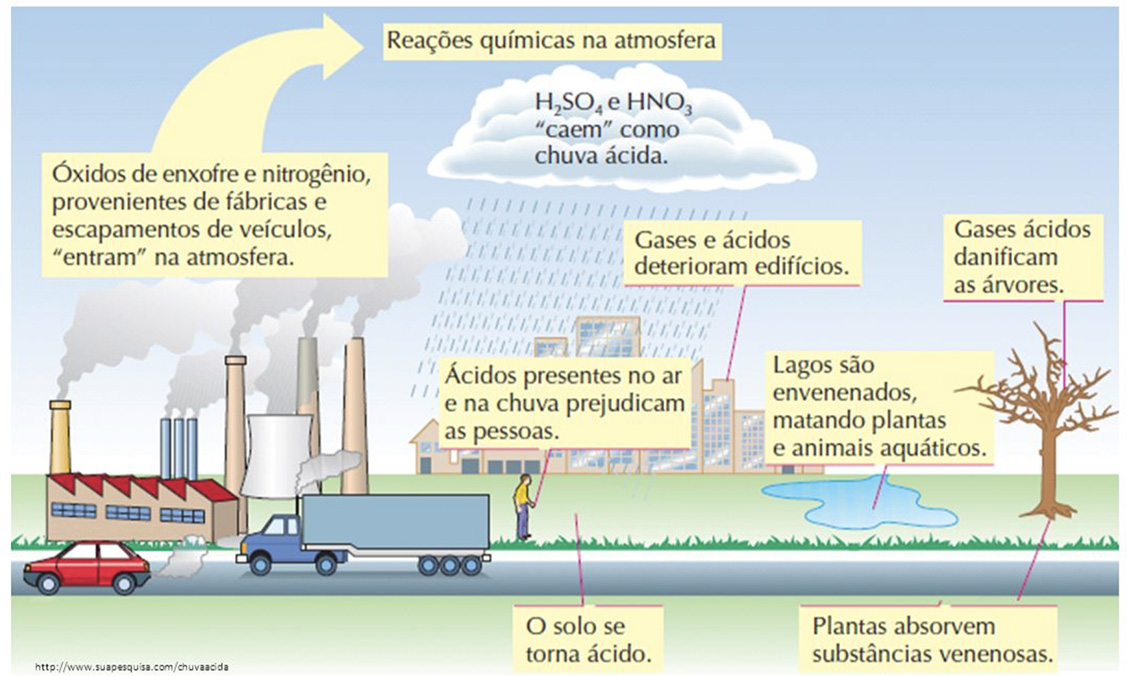
Figura 6 – Formação da chuva ácida.
Reações de esterificação
Ocorre quando um álcool reage com um ácido carboxílico, resultando em éster e água. Estão presentes no cotidiano por sua utilização na produção de biodiesel e de flavorizantes na indústria alimentícia, além de serem matérias-primas da fabricação de explosivos, como a nitroglicerina.
O biodiesel é um biocombustível de fontes renováveis, proveniente de óleos vegetais puros, extraídos de mamona, milho, soja, babaçu, entre outros, como também de resíduos de óleos de fritura, contribuindo para a redução de gases de efeito estufa, por ser menos poluente.
Para a produção de biodiesel é necessário ocorrer uma reação de transesterificação, onde são adicionados um éster (óleo vegetal ou gordura), um catalisador (geralmente um ácido ou uma base), e um segundo reagente (álcool, éster ou ácido carboxílico). Os catalisadores mais comuns utilizados são: hidróxido de sódio (NaOH), hidróxido de potássio (KOH), ácido sulfúrico (H2SO4), ácido clorídrico (HCl), alcóxido de sódio (R-ONa) e alcóxido de potássio (R-OK).
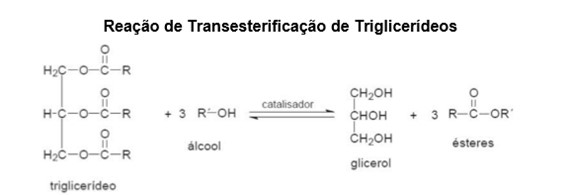
R representa a cadeia carbônica dos ácidos graxos e R’, a cadeia carbônica do álcool reagente. Fonte: Costa Neto & Rossi (2000).
Geometria molecular
A geometria molecular é a forma com que as moléculas se organizam no espaço e depende do número de ligações que o átomo principal faz. A disposição dos átomos de uma molécula está baseada na Teoria da Repulsão dos Pares Eletrônicos (TREPV), a qual afirma que afirma que os elétrons presentes nas nuvens eletrônicas ao redor do átomo central se repelem (afastando-se), alterando o posicionamento dos átomos e determinando assim, a geometria molecular.
Agora, você vai saber quais são as geometrias moleculares que precisa ter na ponta do lápis no momento da prova!
Tipos de geometria molecular
A geometria da molécula é formada de acordo com o número de nuvens de elétrons ligadas ao redor do átomo principal e podem variar de acordo com o número de átomos. Saiba quais são elas!
Geometria Linear
É o tipo de geometria molecular mais simples e ocorre quando há molécula diatômica (formada por dois átomos), onde um átomo se liga ao outro por uma linha reta, ou molécula triatômica (três átomos), quando o átomo central se liga diretamente a outros dois átomos. A triatômica só poderá ser linear quando não houver nenhum par de elétrons não ligantes.
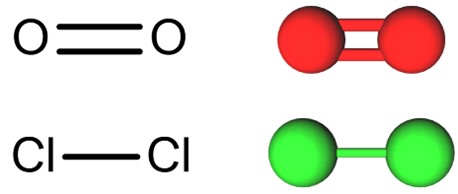
Geometria angular
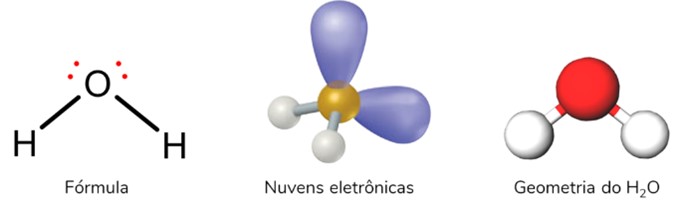
Ocorre quando se tem uma molécula triatômica (três átomos) na qual o átomo central se liga diretamente a outros dois átomos. Essa ligação apresenta, obrigatoriamente, uma ou duas nuvens eletrônicas não ligantes.
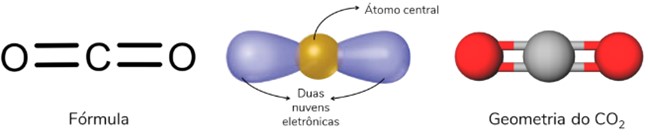
Geometria trigonal plana
Ocorre quando se tem uma molécula tetratômica (quatro átomos) na qual o átomo central se liga diretamente a três outros átomos. Nessa estrutura, não há nuvem eletrônica não ligante, e ela se apresenta na forma de um triangulo plano.
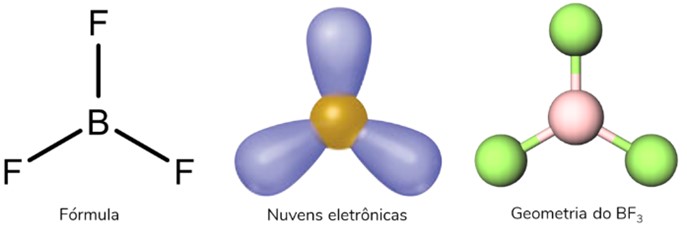
Mas, fique de olho! Para ser uma estrutura trigonal plana, a molécula não pode apresentar par isolado. Nesse caso, teríamos uma geometria angular.
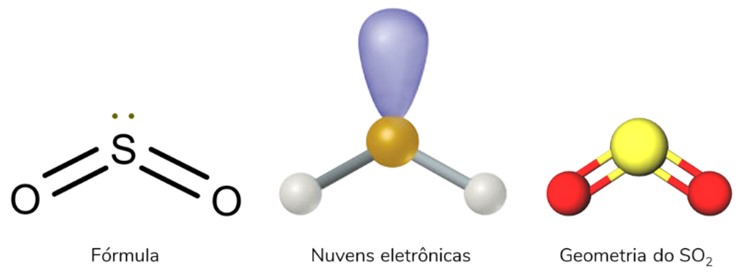
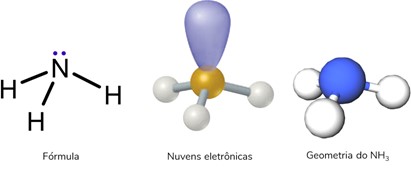
Geometria Piramidal
Ocorre quando se tem uma molécula tetratômica (quatro átomos) na qual o átomo central se liga diretamente a três outros átomos. Essa estrutura apresenta, obrigatoriamente, uma nuvem eletrônica não ligante.
Geometria molecular tetraédrica
Ocorre quando se tem uma molécula pentatômica (cinco átomos) na qual o átomo central não apresenta nuvem eletrônica não ligante, e se liga diretamente a quatro outros átomos.
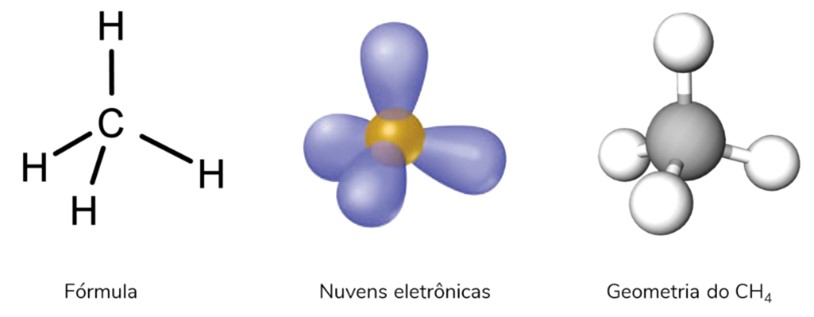
Nessa estrutura, o átomo central não possui par isolado, o que tornaria a sua geometria piramidal. Caso tivesse dois pares isolados, a sua geometria seria angular.
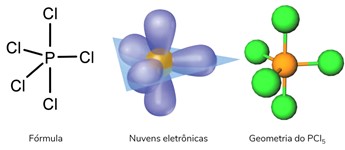
Geometria bipirâmide trigonal
Ocorre quando se tem uma molécula hexatômica (seis átomos) na qual o átomo central se liga diretamente a cinco outros átomos. Neste caso, não há nuvem eletrônica não ligante.
Geometria molecular octaédrica
Ocorre quando se tem uma molécula heptatômica (sete átomos) na qual o átomo central se liga diretamente a outros seis átomos. Neste caso, não há nuvem eletrônica não ligante.
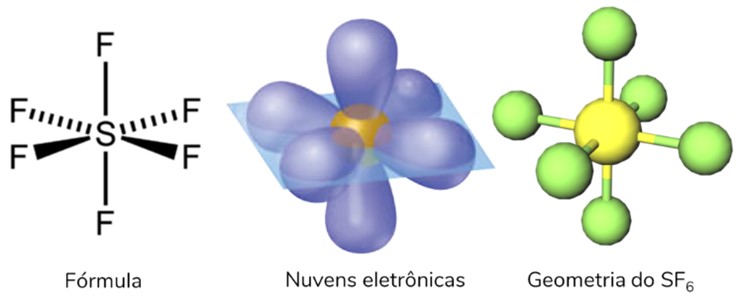
Química orgânica
Os assuntos relacionados à química orgânica costumam ser recorrentes nos vestibulares de todo país, assim como no Enem, por estarem muito ligados a diversos fenômenos do nosso cotidiano.
Essa disciplina se dedica ao estudo dos compostos de carbono – presente nos organismos vivos – e suas características físicas, assim como reações com outros elementos. Ah, e não se esqueça: para reconhecer uma molécula orgânica, observe se ela possui os elementos hidrogênio (H) e carbono (C) em sua estrutura. ?
Veja alguns tópicos importantes sobre esse tema:
Representação das cadeias carbônicas
- Classificação dos carbonos
- Classificação das cadeias carbônicas
- Introdução às funções orgânicas
- Funções orgânicas
- Hidrocarbonetos
- Compostos orgânicos oxigenados
- Álcoois
- Compostos orgânicos nitrogenados
- Compostos orgânicos sulfurados
- Compostos organoclorados
- Haletos orgânicos
- Organometálicos
- Nomenclatura IUPAC
- Isomeria
- Reações orgânicas
- Reações com álcoois
- Reações com aldeídos e cetonas
- Reações com ácidos carboxílicos
- Reações dos ésteres
- Reações de aminas
- Polímeros
Para dar uma forcinha com os seus estudos, confira o nosso guia de química orgânica! ?
Química inorgânica
A química inorgânica é o ramo da química responsável por estudar os compostos inorgânicos, ou seja, que não apresentam em sua estrutura átomos de carbono (C) e hidrogênio (H).
Os conhecimentos em funções inorgânicas são fundamentais para interpretar e balancear as reações químicas, como formação de substâncias tóxicas ou poluentes ambientais, além dos conceitos de ácidos, bases, óxidos e sais. Os compostos inorgânicos se caracterizam por serem iônicos, sólidos em temperatura ambiente (exceto os ácidos líquidos e alguns óxidos gasosos) e por apresentarem metais em sua composição.
Para se preparar para os vestibulares, alguns temas dessa disciplina precisam ser muito bem aprofundados. Confira!
- Ácidos: substâncias que se ionizam em água, formando o cátion hidrônio;
- Bases: substâncias dissociadas em água e que liberam o ânion hidroxila;
- Sais: substâncias dissociadas em água e que liberam um cátion diferente do hidrônio e um ânion diferente da hidroxila;
- Óxidos: compostos de natureza binária que apresentam oxigênio como o mais eletronegativo;
- Carbetos: compostos de natureza binária e que apresentam carbono, quando ligado a metais ou a semimetais, como o mais eletronegativo;
- Hidretos: compostos de natureza binária e que apresentam hidrogênio como o mais eletronegativo;
- Reações de neutralização: reações que originam sais a partir de um ácido e uma base;
- Reações de dupla troca: reações que produzem sal e ácido, sal e base ou dois sais, a partir dessas substâncias;
- Reações de deslocamento: reações que resultam em substâncias simples, compostas a partir de outras substâncias de mesma natureza;
- Reações de ustulação: reações que ocorrem a partir da combustão de sulfetos.
Energia
Ainda que não exista uma definição exata para o termo energia, podemos afirmar que ela é resultado de uma ação e pode se manifestar na forma de calor, eletricidade, movimento etc.
Lavoisier, em seu estudo, diz que a energia não pode surgir do nada ou ser destruída, mas transformada em outro tipo de energia. Um exemplo disso são as usinas hidrelétricas, que transformam a energia do movimento da água (nas quedas d’água) em energia elétrica.
A energia pode ser obtida por meio das fontes finitas, ou não renováveis, como a que é formada a partir de combustíveis fósseis (petróleo e o carvão). Já a energia renovável é obtida por meio de recursos que apresentam capacidade de se recuperarem naturalmente, como a luz do sol e a força dos ventos (energia eólica). Essas fontes também são chamadas de limpas.
Para que você saiba um pouco mais sobre esse assunto, que permeia tanto o campo da química quanto o da física, vamos trazer agora as principais formas de energia para que você possa se aprofundar. Confira!
Energia cinética
Essa energia é obtida por meio do movimento dos corpos, de forma que quanto maior a velocidade com que um corpo se movimenta, maior será a sua energia cinética.
Equação:
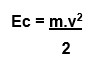
Ec: energia cinética; m: massa; v: velocidade.
Energia potencial
Esse tipo de energia acontece em virtude da posição de um corpo em relação à superfície. Quanto mais alto estiver um objeto, maior será a sua velocidade de queda até o chão. Tal fenômeno, também chamado de energia potencial gravitacional. Caso a energia potencial se relacione à deformação de um material elástico, ela será chamada de energia potencial elástica.
Equação:
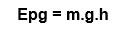
Epg: energia potencial gravitacional; m: massa; g: gravidade; h: altura.
Energia térmica (calor)
A energia térmica está associada à energia cinética das moléculas presentes em um elemento. Quando a energia térmica é transferida entre corpos, ela passa a ser chamada de calor
Energia química
Nesse caso, a energia é liberada a partir das reações químicas resultantes das interações entre as moléculas, como a energia produzida por pilhas e baterias.
Energia solar
Como o nome sugere, é a energia proveniente da luz do sol e pode ser utilizada na produção de energia elétrica por meio de placas fotovoltaicas.
Energia eólica
A produção dessa modalidade de energia acontece por meio do movimento das massas de ar, ou ventos, que, por meio de hélices e turbinas, produzem energia elétrica.
Energia nuclear
A energia nuclear (ou atômica) é produzida a partir da fissão nuclear de um átomo, em que seu núcleo é dividido, gerando um grande volume de energia.
Radioatividade
A radioatividade é o fenômeno que resulta da emissão de energia provocada pelo núcleo dos átomos em decorrência de uma instabilidade ou desintegração de elementos químicos. Nesse processo, o núcleo do átomo sofre alterações, diferentemente das reações químicas, onde as transformações ocorrem em sua eletrosfera. Um átomo é considerado radioativo quando possui a capacidade de se transformar em outro átomo.
Por conta da sua importância, esse assunto costuma ser recorrente na maior parte dos vestibulares, especialmente os tópicos de fusão e fissão nuclear, assim como o cálculo do tempo de meia-vida de um elemento radioativo. Além disso, poderão ser abordadas as situações em nosso cotidiano em que a radioatividade é utilizada, como a esterilização de materiais ou procedimentos radiológicos.
Para te ajudar a organizar os estudos sobre esse tema, vamos listar aqui os tópicos mais importantes:
- Tipos de radioatividade
- Leis da radioatividade
- Elementos radioativos (naturais e artificiais)
- Decaimento radioativo
- Aplicação da radioatividade no cotidiano
- Usinas nucleares
- Lixo radioativo
- Datação por carbono
Estequiometria
A estequiometria é o cálculo da quantidade das substâncias presentes em reações químicas, em que as substâncias reagem entre si e dão origem a produtos em proporções específicas. Com a ajuda do cálculo estequiométrico, é possível prever e calcular o quanto de produto será originado na reação ou o seu rendimento, além do quanto de reagente deverá ser utilizado.
Porém, antes do cálculo, é necessário conhecer as proporções dos elementos nas reações químicas – que são dadas pelas fórmulas moleculares.
Além disso, uma boa dica é se atentar à lei volumétrica de Gay-Lussac: caso a pressão e a temperatura se mantiverem constantes, os volumes dos gases que participam da reação possuem entre si uma relação de números inteiros e pequenos.
Nos vestibulares, muitas questões podem ser resolvidas por regra de três. Os cálculos não são complexos, mas a interpretação do enunciado pode atrapalhar o entendimento do que é pedido. Não se esqueça de estudar conversão de unidades de medida, grandezas químicas (mol) e lei dos gases ideais.
Confira abaixo as regras fundamentais dos cálculos estequiométricos:
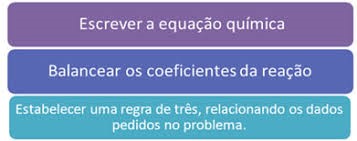
Agora, veja alguns exemplos de aplicação:
Exemplo 1: Relação entre volume e massa
Ao se realizar a calcinação de 200 g de carbonato de cálcio nas condições normais de temperatura e pressão, qual será o volume de gás carbônico obtido? (Dados: Massas atômicas: C = 12; O = 16, Ca = 40).
Resolução:
1º) Equação química balanceada:
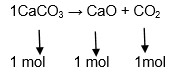
2º) Proporção estequiométrica:
Massa molecular do CaCO3=40 + 12 + (3.16) = 100g/mol Massa molecular do CO2 = 12 + (2.16) = 44 g/mol
3º) Regra de três:
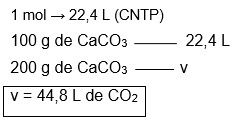
Atomística
Atomística é a disciplina da química dedicada ao estudo átomo, suas características, representações e semelhanças com outros átomos.
O átomo é a menor unidade de toda matéria, ainda que seja composto por partículas subatômicas que o caracterizam como uma estrutura divisível. No modelo atômico mais recente, ele é dividido em duas regiões: eletrosfera e núcleo. Na primeira, encontramos os elétrons que orbitam em camadas energéticas ao redor do núcleo – que, por sua vez, compõem a maior massa do átomo e concentram os prótons, ou partículas positivas, e nêutrons, partículas sem carga.
Para ficar preparado e se dar bem nas questões sobre o assunto, confira a lista de tópicos importantes da área de atomística:
- Modelo atômico de Dalton
- Modelo atômico de Thomson
- Modelo atômico de Rutherford
- Modelo atômico de Bohr
- Estrutura do átomo
- Evolução do modelo atômico
- Distribuição eletrônica
- Íons
- Semelhanças atômicas
Termoquímica
A termoquímica é a área de estudo dedicada à quantidade de energia – ou calor – envolvida nas reações químicas, além da transferência de energia de alguns fenômenos físicos, como as mudanças dos estados da matéria.
Vale ressaltar que o calor, que também é chamado de energia calorífica, representa a troca de energia térmica entre duas matérias. Quando esses dois materiais atingem a mesma temperatura, ocorre o equilíbrio térmico.
As reações estudadas pela termoquímica – e que costumam estar presentes nas questões dos vestibulares – são as endotérmicas e exotérmicas. Conheça as suas definições!
- Reação endotérmica: é quando existe absorção do calor do meio em que um corpo está inserido, o que traz a sensação de resfriamento. Um exemplo desta reação é o processo de cozimento dos alimentos ou a mudança de estado físico da água líquida para vapor.
- Reação exotérmica: quando existe a liberação do calor de um corpo para o meio em que está inserido, trazendo sensação de aquecimento. Os processos de combustão de materiais são exemplos de reações exotérmicas.
Você também deve se atentar ao fenômeno da entalpia, que é liberação energética endotérmica e exotérmica. Os tipos de entalpia são:
- Entalpia de formação: energia liberada ou absorvida necessária para formar 1 mol de determinada sustância;
- Entalpia de combustão: energia liberada na queima de 1 mol de substância;
- Entalpia de ligação: energia absorvida no processo de quebra de 1 mol de ligação química em estado gasoso.
Agora que você já sabe o que estudar, tente se aprofundar o máximo possível em cada um dos temas propostos para chegar no grande dia super preparado para o desafio, combinado?! Para te ajudar, preparamos um plano de estudos completo de Química para você estudar para o Enem e Vestibulares. Basta fazer download abaixo!
Ah, e para testar os seus conhecimentos, faça também o nosso simulado de química. Até a próxima!
Texto escrito por: PRAVALER


