

Tabela periódica completa e atualizada.
A tabela periódica já é uma velha companheira de estudos dos alunos no final do ensino fundamental e ensino médio, mas muita gente não conhece muito bem a sua história e como ela foi criada, ou ainda tem muitas dúvidas sobre a sua função. Aliás, você sabia que 2019 foi o ano da tabela periódica, quando completou 150 anos de existência?
Neste artigo, você vai conhecer algumas curiosidades sobre o seu desenvolvimento e entender como deve ser utilizada em seus estudos. Acompanhe!
Neste artigo você vai encontrar:
O que é tabela periódica?
A tabela periódica é o agrupamento de todos os elementos químicos conhecidos e suas características para facilitar o seu estudo e sofreu pouquíssimas alterações desde que foi criada. Nela, os elementos estão agrupados em ordem crescente de números atômicos, ou seja, o número de prótons.
A tabela possui 118 elementos químicos e cada um dos quadrados traz uma nomenclatura e o número atômico, sendo 92 deles de elementos naturais e 26 artificiais.
Existem dois tipos de organização da tabela periódica: as fileiras horizontais, também chamadas de períodos, estão dispostas de sete em sete e concentram os elementos com número igual de camadas eletrônicas. Já as fileiras verticais, também conhecidas como famílias ou grupos, formam a camada de valência. Parece confuso né? Mas fica tranquilo, pois voltaremos a falar sobre isso mais para a frente, ainda neste artigo.
A história da tabela periódica
As teorias para explicar e classificar a matéria começaram a surgir ainda na Antiguidade, época em que já se tinha a percepção de que toda matéria era formada a partir de quatro elementos – e que poderia ser transformada em outra por meio da fusão com outros elementos, no conceito conhecido como alquimia.
A partir da separação da alquimia da química, em que está a química atingia o status de ciência, e do trabalho de catalogação dos elementos conhecidos naquela época realizado por Antoine Lavoisier, outros estudos para a compreensão da matéria passaram a ser publicados, o que levou a inúmeros outros conhecimentos adquiridos pelos cientistas em relação às propriedades dos elementos.
No entanto, o que pode se chamar de protótipo da tabela periódica surgiu por volta de 1829, quando os químicos da época sentiram a necessidade de organizar e classificar os elementos químicos já conhecidos até então. Os estudiosos já possuíam alguns conhecimentos sobre as características de 30 elementos, como a densidade, a massa atômica, o ponto de fusão e ponto de ebulição, além da sua reatividade e estado físico onde são encontrados na natureza.
Com a descoberta gradual dos elementos, os cientistas passaram a se dedicar a estruturação de modelos para organizá-los utilizando como critério as suas propriedades como sistema de classificação. A primeira tentativa ocorre ainda em 1829, com a proposta da “Lei das Tríades” de Johann Wolfgang Döbereiner, em que os elementos são dispostos em números de três, com propriedades similares.
Ao longo dos anos seguintes, outros químicos formularam teorias para organizar os elementos, e essas tentativas foram se aproximando da estrutura da tabela periódica tal qual a conhecemos hoje.
Quem criou a tabela periódica?
O primeiro modelo de tabela periódica que contemplava todos os elementos químicos foi o chamado parafuso telúrico de Chancourtois, um geólogo francês que percebeu a periodicidade desses elementos. Posteriormente, outros estudiosos publicaram seus modelos de tabela, mas nenhum deles teve ampla aceitação da comunidade acadêmica.
Em 1869, Dmitri Mendeleev, um químico e físico russo, propôs o primeiro modelo considerado adequado para representar os elementos químicos pelos cientistas da época. Em 1870, Lothar Meyer também publicou a sua versão, que também obteve reconhecimento. Ambos os modelos eram estruturados de forma semelhante, com linhas e colunas ordenadas de acordo com a massa atômica e iniciando uma nova coluna ou linha quando as propriedades dos elementos se repetiam.
Como surgiu a tabela periódica?
Após a publicação das tabelas periódicas dos dois estudiosos, o modelo de Mendeleev acabou se tornando o padrão aceito como definitivo graças a duas medidas que implantou. A primeira foi deixar espaços na tabela que pareciam estar destinados a elementos que ainda não haviam sido descobertos, predizendo, inclusive, as suas propriedades atômicas, como ocorreu com o Gálio e o Germânio. Já a segunda medida foi ignorar em alguns casos a ordem sugerida pelas massas atômicas e trocar elementos vizinhos, como o Iodo e o Telúrio, para organizá-los corretamente em suas famílias químicas.
O modelo de tabela de Mendeleev foi aprimorada ao longo do tempo e passou a contemplar os elementos que foram descobertos até que atingisse o padrão que conhecemos atualmente.
A tabela periódica segue em sua história tendo papel fundamental nos estudos científicos, possibilitando a previsão de quais compostos químicos irão resultar na combinação de seus elementos. Isso só ocorre pois os elementos são agrupados não somente pelos números atômicos de cada um, em ordem crescente, mas também pela sua distribuição eletrônica, ou seja, a quantidade de elétrons presentes na camada de valência.
Quais são os grupo ou famílias da tabela periódica?
Você já viu aqui neste artigo que os elementos químicos são organizados em sequências verticais, também chamadas de grupos ou famílias, e sequências horizontais, os períodos. Agora, vamos explicar melhor o que significa essa organização dentro da tabela.
A tabela periódica conta com 18 colunas, que agrupam os elementos com propriedades químicas semelhantes. Essa foi uma maneira mais funcional de organizar e classificar essas características e apresentá-las de forma mais simples. Essas 18 colunas são chamadas, também, de grupos ou famílias, que são representadas de 1 a 18, dessa forma:
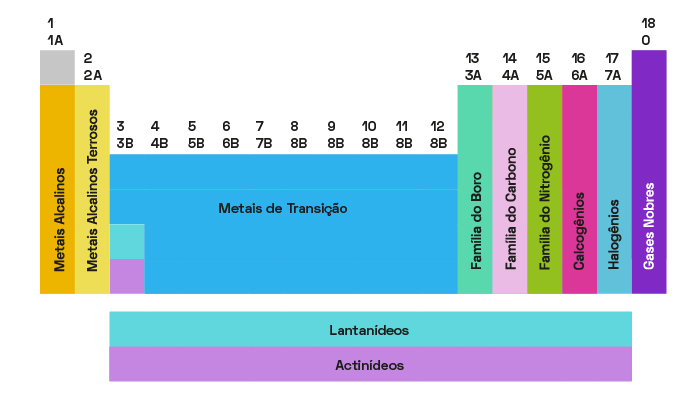
- Família 1A (Grupo 1): Metais Alcalinos
- Família 2A (Grupo 2): Metais Alcalino-Terrosos
- Família B (Grupo 3 a 12): Metais de Transição
- Família 3A (Grupo 13): Família do Boro
- Família 4A (Grupo 14): Família do Carbono
- Família 5A (Grupo 15): Família do Nitrogênio
- Família 6A (Grupo 16): Calcogênios
- Família 7A (Grupo 17): Halogênios
- Família 0 ou 8A (Grupo 18): Gases Nobres
Classificação dos elementos
A numeração das famílias começa na posição 1A e continua até o 0, dividindo-se em Metais, Não-Metais, Semimetais e Gases Nobres. Vamos falar sobre as características de cada um deles agora, acompanhe:
Metais
Os metais formam a maior parte dos elementos existentes (dois terços, ou 87 elementos). Em temperatura ambiente, são materiais sólidos e duros, com exceção do mercúrio, que está no estado líquido. Suas principais características são a condução de calor e eletricidade, maleabilidade e ductibilidade (capacidade de formar fios, como os fios de cobre por exemplo, utilizados na condução da energia elétrica), além do brilho metálico característico desses materiais.
Os elementos que formam as famílias 1 e 2 são denominados metais alcalinos (do árabe álcali, que significa “cinza de plantas”) e metais alcalino-terrosos (que significa “existir na terra”). Os metais estão subdivididos em três partes:
- Metais representativos, típicos ou característicos: 19 elementos pertencentes às colunas A.
- Metais de transição: 32 elementos pertencentes às colunas 3 a 12 ou 3B, 4B, 5B, 6B, 7B, 8B, 1B e 2B.
- Metais de transição interna: 26 elementos da série dos Lantanídeos e dos Actinídeos.
Ametais ou Não Metais
Os Ametais ou Não Metais formam um conjunto de 11 elementos: Carbono (C), Nitrogênio (N), Fósforo (P), Oxigênio (O), Enxofre (S), Selênio (Se), Flúor (F), Cloro (Cl), Bromo (Br), Iodo (I) e Astato (At). Esses materiais possuem características que os opõem aos Metais, já que não são bons condutores de calor e eletricidade e funcionam como isolante. Não possuem brilho metálico característico.
Semimetais
Existem sete semimetais catalogados: Boro (B), Silício (Si), Germânio (Ge), Arsênio (As), Antimônio (Sb), Telúrio (Te) e polônio (Po). Também chamados de metaloides, esses elementos contam com propriedades intermediárias entre Metais e Não Metais: são semicondutores de calor e energia, apresentam brilho metálico, formam óxidos anóferos (que reagem tanto com meio ácido quanto com bases fortes, formando sal e água) e apresentam ligeira sobreposição da banda de condução com a camada de valência. Formam cátions quando ligados a metais e ânions quando ligados a um ametal.
Gases Nobres e Hidrogênio
Os Gases Nobres representam os elementos que compõem a família 18 ou 0, que são: Hélio, Neônio, Argônio, Criptônio, Xenônio e Radônio. São elementos gasosos quando em temperatura ambiente e são encontrados na natureza em forma isolada, o que garante a estabilidade desses materiais. Não formam compostos com outros elementos de forma espontânea.
Já o Hidrogênio não se enquadra em nenhuma família da tabela periódica e, em algumas tabelas, aparece no grupo dos alcalinos por apresentar um elétron em sua camada de valência – sua única camada eletrônica. Porém, suas propriedades não são semelhantes às dos elementos deste grupo.
O Hidrogênio é o elemento que mais está em abundância no universo e é altamente compatível com ametais e semimetais. É normalmente encontrado em altas camadas da atmosfera ou em combinação com outros elementos, além de ser altamente inflamável em temperatura ambiente.
Períodos da tabela periódica
Os períodos são, dentro na organização da tabela periódica, os elementos distribuídos de forma crescente da esquerda para a direita em linhas horizontais a partir do número atômico de cada elemento. Os períodos apontam o número de camadas ou níveis eletrônicos que cada átomo possui – o Potássio (K), por exemplo, está localizado no quarto período e possui quatro camadas eletrônicas. Já o Césio (Cs) está no sexto período e possui seis camadas. Nesse aspecto, o Paládio (Pd) é o único elemento que não segue essa regra, já que mesmo estando na quinta linha horizontal, possui apenas quatro níveis eletrônicos.
Os elementos que estão dispostos no mesmo período contam sempre com o mesmo número de camadas eletrônicas, que por sua vez coincide com o número do período.
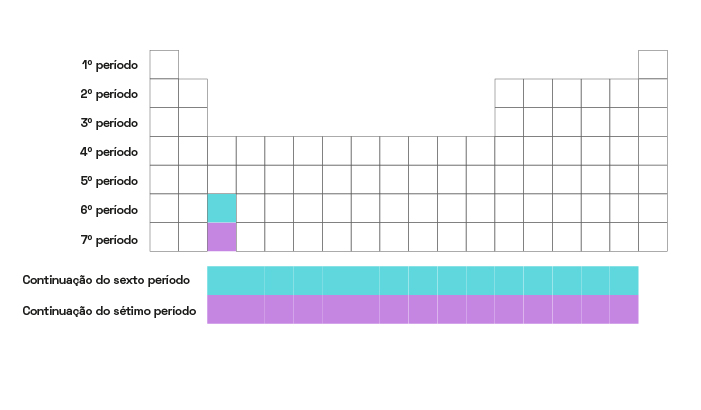
Ao sabermos o período que qualquer elemento ocupa na tabela periódica, é possível descobrir o número de níveis e a camada de valência de cada átomo sem que exista a necessidade de realizar uma distribuição eletrônica.
Abaixo mostraremos uma tabela periódica que destaca apenas alguns elementos químicos que servem como orientação. Através dele, poderemos saber os períodos, número de níveis e camada de valência.
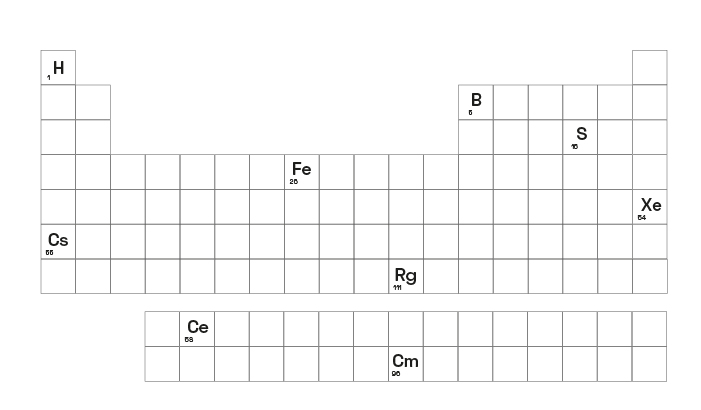
- Hidrogênio (H): Está no 1º período; apresenta átomos com apenas 1 nível; primeira camada de valência.
- Boro (B): Está no 2º período; apresenta átomos com 2 níveis; segunda camada de valência.
- Elemento Enxofre (S): Está no 3º período; apresenta átomos com 3 níveis; terceira camada de valência.
- Ferro (Fe): Está no 4º período; apresenta átomos com 4 níveis; quarta camada de valência.
- Xenônio (Xe): EEstá no 5º período; apresenta átomos com 3 níveis; quinta camada de valência.
- Césio (Cs): Está no 6º período; apresenta átomos com 6 níveis; sexta camada de valência.
- Roentgênio (Rg): Está no 7º período; apresenta átomos com 7 níveis; sétima camada de valência.
- Cúrio (Rg): Está no 7º período; apresenta átomos com 7 níveis; sétima camada de valência.
Tabela Periódica em PDF
Acesse aqui a tabela periódica em PDF para salvar em seu computador ou smartphone.
Queremos ajudar você a estudar e se dar bem nas provas escolares, vestibulares ou o Enem!
Texto escrito por: PRAVALER



